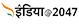Corona Vaccine: स्वदेशी कोरोना वैक्सीन पर क्यों हो रहा है विवाद, जानें भारत बायोटेक ने सफाई में क्या कहा
विपक्षी दल के कुछ नेताओं ने भारत बायोटेक के टीके को मंजूरी देने पर सवाल उठाए हैं. भारत बायोटेक के अध्यक्ष कृष्णा इल्ला का कहना है कि उनकी वैक्सीन को इसलिए निशाना बनाया जा रहा है क्योंकि यह एक भारतीय कंपनी का प्रोडक्ट है.

नई दिल्ली: भारत बायोटेक की कोरोना वैक्सीन को भारत में मंजूरी दिए जाने के बाद से कंपनी को लगातार आलोचनाओं का सामना करना पड़ रहा है. देश की अपनी स्वदेशी कोवैक्सीन पर कांग्रेस के कुछ नेताओं ने सवाल उठाए हैं और तीसरे चरण के परीक्षण डाटा मौजूद नहीं होने पर चिंता जताई है. भारत बायोटेक ने इन आलोचनाओं को खारिज कर दिया और कहा कि इसका सुरक्षित और प्रभावी वैक्सीन उत्पादन का रिकॉर्ड रहा है और इसके सभी डाटा पारदर्शी हैं.
"बिना तीसरे चरण के ट्रायल के कोवैक्सीन को हरी झंडी क्यों?" कांग्रेस नेता शशि थरूर ने बिना तीसरे चरण के परीक्षण के भारत बायोटेक के कोविड वैक्सीन को मंजूरी देने के लिए सरकार की जमकर खिंचाई की है. थरूर ने कहा, "हम सिर्फ इतना ही कह रहे हैं कि अगर टीका प्रभावी रूप से काम किया तो ये हमारे लिए गर्व की बात होगी. लेकिन तीसरे चरण के नैदानिक परीक्षण से पहले इसे मंजूरी देना वैज्ञानिक प्रोटोकॉल का उल्लंघन है, जो अब तक कहीं भी दुनिया में नहीं हुआ है. अंध राष्ट्रभक्ति कॉमन सेंस का विकल्प नहीं हो सकती."
थरूर ने कहा, "लेकिन स्वास्थ्य मंत्री ने कहा कि 'इसके काम करने की अधिक संभावना है' और 'इस बात की भी संभावना है कि दूसरे वैक्सीन की तरह ये भी असरदार हो'. ये बात आश्वस्त करने वाली नहीं है. 'लाइकली' शब्द तीसरे चरण के नैदानिक परीक्षण के बाद ही 'सर्टेन' में बदल सकता है."
भारत बायोटेक का जवाब भारत बायोटेक के अध्यक्ष कृष्णा इल्ला ने कहा '200 फीसदी ईमानदारी के साथ क्लीनिकल ट्रायल किए गए' फिर भी 'आलोचना' की जा रही है. पर्याप्त डेटा का पहले ही खुलासा कर दिया गया है और लोगों के लिए यह ऑनलाइन मौजूद है. कोवैक्सीन मेडिकल जरूरतों को पूरा करता है और इसने शानदार सुरक्षा डेटा सृजित किया है और इसकी रोग प्रतिरोधी क्षमता ठोस है. भारत बायोटेक के अध्यक्ष कृष्णा इल्ला का कहना है कि उनकी वैक्सीन को इसलिए निशाना बनाया जा रहा है क्योंकि यह एक भारतीय कंपनी का प्रोडक्ट है. कोवैक्सीन के तीसरे चरण की डेटा मार्च तक उपलब्ध होगा.
कंपनी के अध्यक्ष ने कहा, 'हम 200 फीसदी ईमानदारी से क्लीनिकल परीक्षण करते हैं और फिर भी हमारी आलोचना हो रही है. भारत बायोटेक का टीका फाइजर के टीके से कमतर नहीं है. भारतीय कंपनियों को निशाना बनाया जा रहा है उन्हें 'घटिया' बताया जा रहा है. यह कहना गलत है कि भारत बायोटेक का डाटा पारदर्शी नहीं है. आपातकालीन उपयोग की मंजूरी भारत सरकार के 2019 के नियमों पर आधारित है.'
एम्स के डायरेक्टर ने कहा- भारत बायोटेक का टीका बैक-अप के लिए है विवादों के बीच अखिल भारतीय आयुर्विज्ञान संस्थान (एम्स) के निदेशक रणदीप गुलेरिया ने कहा कि भारत बायोटेक के टीके को मंजूरी 'बैकअप' के तौर पर केवल आपातकालीन स्थिति के लिए दी गई है और इन दावों को खारिज कर दिया कि टीका की पूरी प्रक्रिया को 'फास्ट ट्रैक' किया गया. उन्होंने कहा, 'अगर मामलों में बढ़ोतरी हो रही है तो हमें टीके के बड़े डोज की जरूरत होगी और तब हम भारत बायोटेक के टीके का इस्तेमाल कर सकते हैं. भारत बायोटेक का टीका बैक-अप के लिए है.'
उन्होंने कहा, 'सुरक्षा और प्रभाव के संदर्भ में किसी भी क्लीनिकल परीक्षण को फास्ट ट्रैक नहीं किया गया. नियामक की मंजूरी लेने में फास्ट ट्रैक किया गया है जिसमें एक चरण से दूसरे चरण तक जाने में सामान्य तौर पर ज्यादा समय लगता है.'
ये भी पढ़ें- कोरोना अपडेट: 6 महीने बाद आए सबसे कम मरीज, देश में अब तक करीब डेढ़ लाख मरीजों की मौत, एक करोड़ ठीक हुए देश पर मंडराया 'बर्ड फ्लू' का खतरा, हिमाचल में हुई 1800 प्रवासी पक्षियों की मौत, एमपी-गुजरात भी हालात बुरे
ट्रेंडिंग न्यूज
टॉप हेडलाइंस